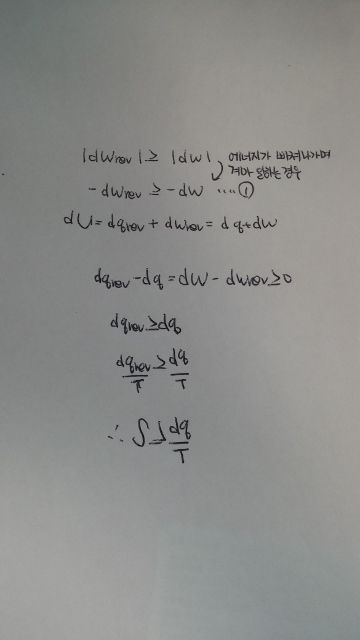열역학 clausius부등식 질문드립니다!
페이지 정보
물려받다 작성일2014-07-22 14:08관련링크
본문
열역학을 공부하던 중에
clausius부등식에서 궁금한 점이 있어서 글을 올립니다.
첨부한 사진에서
가역과정은 비가역과정보다 일을 더 많이 할 수 있으므로
1번식을 유도할 수 있습니다.
그리고 내부에너지는 상태함수이므로 가역과정으로 진행되던 비가역과정으로 진행되던 처음 상태와 나중 상태가 같다면 같으므로 식을 풀어나가면 맨 마지막 식을 도출 할 수 있습니다.
이 식이 clausius부등식 인데 왜 이식을 만족하면 자발적인 반응이라고 하는지 이해가 안됩니다. 단순히 가역과정과 비가역과정을 비교하여 도출한 식에서 자발적인 과정을 어떻게 생각해야하는건지 궁금합니다!!
clausius부등식에서 궁금한 점이 있어서 글을 올립니다.
첨부한 사진에서
가역과정은 비가역과정보다 일을 더 많이 할 수 있으므로
1번식을 유도할 수 있습니다.
그리고 내부에너지는 상태함수이므로 가역과정으로 진행되던 비가역과정으로 진행되던 처음 상태와 나중 상태가 같다면 같으므로 식을 풀어나가면 맨 마지막 식을 도출 할 수 있습니다.
이 식이 clausius부등식 인데 왜 이식을 만족하면 자발적인 반응이라고 하는지 이해가 안됩니다. 단순히 가역과정과 비가역과정을 비교하여 도출한 식에서 자발적인 과정을 어떻게 생각해야하는건지 궁금합니다!!
댓글 3
재료님의 댓글
재료
답은 질문에 벌써 써 놓으셨습니다.
가역과정은 비가역과정보다 일을 더 많이 할 수 있으므로,
다른 말로 쓰면 가역과정에서 넣어 준 에너지보다 비가역인 상태에서 항상 에너지를 더 소모하므로 (관찰에 의한 사실)
부등식은 항상 S쪽으로 열리게 되어 있지요
물려받다님의 댓글
물려받다
답변 감사합니다!
제가 궁금한 부분은 저 식으로 부터 '자발성이 어떻게 설명되는 가'였습니다. 저 식을 일정 온도와 일정 압력조건에서 정리하게 되면 dG<0이 나오게 되는데 이는 자발성의 척도가 됩니다.
clausius부등식은 단순히 가역과정과 비가역과정을 비교한 식인데 갑자기 저식으로 '왜 자발성이 설명되는가'를 이해 못하겠습니다!
재료님의 댓글
재료
지금 뭔가 잘못 생각하고 있는데
클라우시스는 열역학 2법칙을 만든 사람이 아닙니다.
비가역과정에서 에너지를 언제나 잃는다는 사실은 클라우시스 식을 보고 알게 된 게 아닙니다. 관찰된 사실이죠.
클라우시스는 상기 관찰된 사실 (열역학 2법칙)을 수식으로 나타낸 겁니다.
여러 복잡한 반응계에서 G 만 고려하면 자발성을 알 수 있으므로 유용한거지요.